Publication dans Science
Le professeur Luis Daniel Cruz Zaragoza réalise une percée en génétique mitochondriale

Photo : Jessica Garneau, UdeS
Depuis l’invention de l'ARN interférent (ARNi) et du ciseau génétique CRISPR-Cas9, les biologistes, généticiens et biotechnologues peuvent contrôler l'expression génique et modifier avec grande précision l’ADN des organismes vivants – un exploit extraordinaire qui a ouvert la voie à de vastes applications en médecine, en agriculture et en recherche. Cependant, au cœur même de la cellule, dans les mitochondries, une part cruciale du code génétique essentiel à la vie reste largement inaccessible : l’ARN et l'ADN mitochondriaux (ARNmt, ADNmt). Grâce à une technique hautement innovatrice appelée silencing mitochondrial, développée par le professeur Luis Daniel Cruz Zaragoza (Université de Sherbrooke) en compagnie du Pr Peter Rehling (University Medical Center de Göttingen) et d'une équipe de collaborateurs, la science peut enfin dépasser cette frontière et accéder au dernier repaire de notre code génétique.
Un interrupteur pour éteindre l’expression des gènes mitochondriaux
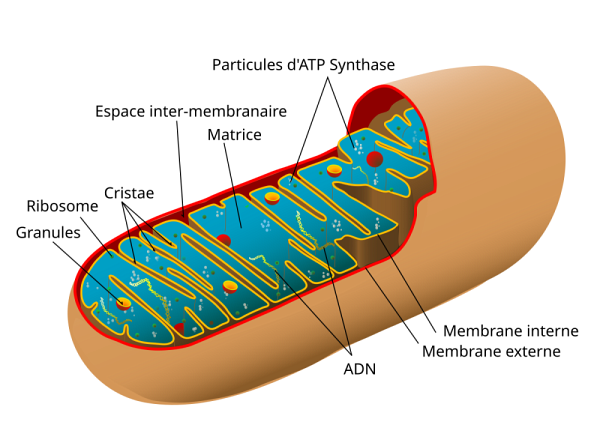
Photo : Wikipedia - Image libre de droits
Souvent comparées à des centrales énergétiques, les mitochondries jouent un rôle central dans la production de l’adénosine triphosphate (ATP), la principale molécule utilisée par les cellules pour accomplir leurs fonctions. C’est pourquoi de nombreux chercheurs à travers le monde ambitionnent depuis longtemps de modifier le système d'expression des protéines dans les mitochondries, dont le dysfonctionnement est associé à plusieurs maladies neurodégénératives, cardiaques ou métaboliques, notamment chez les enfants. Mais jusqu’ici, aucune technologie pour cibler l'ARN ne permettait de franchir les barrières mécaniques et biologiques propres au milieu mitochondrial dans des cellules vivantes.
« CRISPR-Cas9, par exemple, fonctionne grâce à un ARN guide qui dirige une enzyme vers une séquence précise d’ADN à couper. Or, en plus de la limite physique imposée par leur double membrane, les mitochondries ne possèdent pas de mécanisme efficient pour importer cet ARN guide à partir du cytoplasme, explique le professeur Cruz Zaragoza. Dans ce milieu très différent de celui du noyau cellulaire, il faut donc trouver une autre façon de franchir ces obstacles pour atteindre les séquences génétiques. »
Pour accomplir cet exploit dans des cellules vivantes, l’équipe a mis au point des molécules hybrides dites « chimères », capables de pénétrer les mitochondries et d’empêcher la fabrication de protéines ciblées. Faciles à synthétiser et à administrer, ces chimères sont stables et actives dans l’environnement mitochondrial. Elles comprennent, d’un côté, une petite balise qui les oriente vers la mitochondrie et, de l’autre, un fragment synthétique d’oligonucléotide antisens conçu pour se fixer à l’ARN messager du gène et bloquer sa traduction en protéine, sans l'endommager. Les chercheurs peuvent ainsi « éteindre » sélectivement l’expression d’un gène mitochondrial, comme un interrupteur.
Contrairement aux autres approches proposées jusqu’ici, notre technique nous offre un accès précis et sécuritaire qui nous permet d’étudier la fonction des gènes mitochondriaux dans la cellule vivante, sans en altérer le génome. Nous ne pouvons pas encore parler d’un équivalent à CRISPR pour l’ADNmt, mais nous accomplissons des progrès substantiels que plusieurs croyaient impossibles.
Pr Luis Daniel Cruz Zaragoza

Photo : Copyright Science. Image extraite de l'article original
Contrôler les mitochondries pour comprendre la cellule
Grâce à cette technique, les chercheurs ont pu observer pour la toute première fois la réaction d’une cellule lorsqu'un gène mitochondrial est désactivé. Résultat : ses fonctions énergétiques chutent rapidement et son noyau enclenche alors des mécanismes d’urgence pour compenser. « Cela révèle une communication intime entre les mitochondries et le noyau, jusqu’ici très mal comprise, qui est essentielle pour la santé cellulaire, poursuit le Pr Cruz Zaragoza.»
Ces avancées très concrètes pour l’étude de la biologie mitochondriale, dont la description précise est parue dans Science, ouvrent la voie à de nouveaux modèles de recherche et à des stratégies thérapeutiques ciblées pour s’attaquer aux maladies graves liées à l’expression de l’ADNmt.
Le Québec et l'UdeS se positionnent ainsi à l’avant-garde de la recherche mondiale dans ce domaine qui sauvera des vies et comblera une lacune importante dans notre compréhension de la génétique du vivant.
Des chimères qui n'ont rien de mythologique
Les chimères biologiques, comme les chimères morpholino-peptides utilisées par le professeur Cruz Zaragoza, sont des systèmes hybrides (par exemple, des molécules) composés deux éléments différents ou plus, qu'on synthétise dans le but d'explorer et de comprendre les mécanismes fondamentaux du vivant.
Les morpholinos : des alliés exceptionnels
Les morpholinos sont des oligomères synthétiques utilisés en biologie moléculaire pour modifier l'expression de gènes. Ils agissent comme des analogues d'acides nucléiques qui se lient à des séquences spécifiques d'ARNm pour bloquer la traduction ou l'épissage, empêchant ainsi la production de protéines. Cette technique est particulièrement utile pour étudier la fonction des gènes.
Qu’est-ce que CRISPR-Cas9?
Utilisé en recherche fondamentale, en agriculture, et en médecine, notamment pour développer des thérapies géniques, CRISPR-Cas9 est un outil de modification génétique révolutionnaire inspiré d’un mécanisme naturel de défense des bactéries contre les virus. Sa précision, sa simplicité et son faible coût en font un outil majeur de la biotechnologie moderne.
Génome nucléaire ou mitochondrial?
Compact, énergétique et d’origine maternelle, le génome mitochondrial est fort différent du génome nucléaire, qui est plutôt central et d’origine biparentale. Les deux coopèrent pour assurer le bon fonctionnement des cellules.
Génome nucléaire (hérité de la mère et du père)
Localisation : dans le noyau cellulaire
Taille : très grand (~3 milliards de paires de bases chez l’humain)
Nombre de gènes : ~20 000 à 25 000
Structure : linéaire, réparti sur 46 chromosomes (chez l’humain)
Fonctions : contrôle la majorité des fonctions cellulaires, développement, métabolisme
Réparation : possède des systèmes complexes de réparation de l’ADN
Génome mitochondrial (hérité de la mère)
Localisation : dans les mitochondries
Taille : très petit (~16 569 paires de bases chez l’humain)
Nombre de gènes : 37
Structure : circulaire, comme les bactéries
Fonctions : contient les instructions nécessaires à la fabrication de l'ATP
Réparation : mécanismes de réparation limités, plus vulnérable aux mutations
References
Cruz-Zaragoza L.-D., Dahal D., Koschel M., Boshnakovska A., Zheenbekova A., Yilmaz M., Morgenstern M., Dohrke J.-N., Bender J., Valpadashi A., Henningfeld K.-A., Oeljeklaus S., Kremer L.-S., Breuer M., Urbach O., Dennerlein S., Lidschreiber M., Jakobs S., Warscheid B., Rehling P. (2025) : Silencing mitochondrial gene expression in living cells. In Science DOI: 10.1126/science.adr3498.