Recherche sur la COVID-19
Bloquer le chemin au coronavirus dès son entrée dans l’organisme

Le 6 mars dernier, la section « nouvelles » de l’Institut de pharmacologie de Sherbrooke publiait un article annonçant que Richard Leduc (professeur-chercheur à l’Université de Sherbrooke, au CRCHUS et membre de l’IPS) était l’un des quelques experts de l’UdeS à recevoir une subvention des Instituts de Recherche en Santé du Canada dans le but d’étudier le SRAS-CoV-2 responsable de la COVID-19. Si les scientifiques à travers le monde redoublent leurs efforts dans l’espoir de contrer cette pandémie, le Pr. Leduc et son équipe ne font pas exception. Et si son hypothèse permettait de stopper la prolifération du virus en lui coupant l’herbe sous le pied avant qu’il ne pénètre la membrane cellulaire?
Alors que nous entrons dans la deuxième vague et que le cap du million de morts est désormais franchi, l’équipe du Pr. Leduc ne ménage pas ses efforts pour faire progresser la recherche en ce qui a trait au nouveau coronavirus. Alors que certains s’intéressent à la recherche d’un vaccin qui assurerait une immunité collective à long terme, d’autres cherchent à traiter les complications reliées à la présence du virus dans l’organisme à l’aide de corticostéroïdes. De son côté, le laboratoire Leduc s’intéresse au mécanisme d’entrée du virus dans l’organisme et à une façon de contrecarrer celui-ci, stoppant ainsi la reproduction du virus à l’intérieur des cellules humaines.
Une rencontre entre un « spike » opportuniste et une protéase altruiste
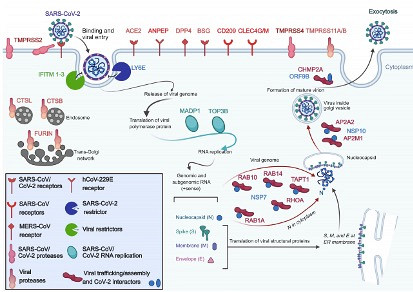
L’observation du Pr. Leduc prend la forme d’une rencontre fusionnelle entre la protéine « Spike », c’est-à-dire la protéine qui donne son air « punk » au virus du SRAS-CoV-2, et une sérine protéase (type d'enzyme) située sur la surface de la membrane de plusieurs de nos cellules (schéma, « TMPRSS2 »). Dès leur rencontre, la compatibilité est fatale : TMPRSS2 met en branle son principal talent et clive (coupe) Spike, ce qui permet à cette dernière de fusionner avec la cellule de son hôte : c’est l’entrée du virus dans l’organisme. Une fois à l’intérieur, le virus exploite complètement la « machinerie » de la cellule infectée afin de commencer la production de plusieurs millions de virions qui iront à leur tour infecter d’autres cellules du corps de l'hôte une fois leur gestation terminée.
Pour le professeur Leduc, le mécanisme « catastrophe » devient une opportunité à saisir : « Ça fait plus de trente ans que nous travaillons sur les protéases et sur des molécules pouvant inhiber temporairement certaines d’entre elles. » En effet, l’hypothèse sur laquelle repose la recherche est qu’en empêchant TMPRSS2 de faire son principal travail (c’est-à-dire de couper les protéines), on pourrait ultimement empêcher le virus d’intégrer les cellules et de se propager dans l’organisme. « En inhibant la protéase TMPRSS2, le virus se retrouverait coincé sur le récepteur de la cellule (schéma, « ACE2 ») et sujet à se faire éliminer par phagocytose ou par d’autres mécanismes naturels mis en place par le système immunitaire. ». D’ailleurs, en se basant sur ces mêmes observations, plusieurs universités américaines renommées telles que Yale et Stanford ont déjà commencé des essais cliniques avec une molécule inhibitrice de la TMPRSS2.
Les professeurs Philippe Sarret et Éric Marsault de l’IPS travaillent de pair avec le laboratoire Leduc afin d’élaborer des molécules et des modèles de propagation virale qui permettront de valider cette hypothèse fort intéressante. Également, le Dr. Gary Whittaker de l’Université Cornell et le Dr. François Jean de l’Université de la Colombie-Britannique (UBC) sont des collaborateurs externes précieux en matière de modèles d’animaux et d’organoïdes, deux éléments primordiaux dans la phase d’essais précliniques de la recherche.
Un combat sur plusieurs temps et sur plusieurs angles
Chose certaine, le SRAS-CoV-2 a donné et donnera encore du fil à retordre aux experts. Contrairement à son jumeau le SRAS-CoV, le nouveau coronavirus exploite beaucoup plus son hôte dont il utilise pleinement les ressources : « Ce qui rend ce virus particulièrement infectieux, c’est le rôle que joue la furine (une enzyme retrouvée dans toutes nos cellules) lors de la création des virions. Le CoV-2 a une séquence en acides aminés particulière qui lui permet d’être reconnu par la furine, celle-ci préparant la protéine Spike des virions à se faire cliver plus facilement par TMPRSS2 par la suite. Ainsi préparés, les virions sont en mesure d’infecter d’autres cellules de façon plus efficace. », a ajouté le Pr. Leduc. Selon le chercheur, c’est cette particularité en ce qui a trait à la prolifération rapide du virus qui pourrait expliquer en partie les multiples séquelles présentes chez plusieurs patients infectés par le SRAS-CoV-2.
L’urgence de la situation de pandémie rend nécessaire un travail attaquant plusieurs angles et s’intéressant à plusieurs cibles potentielles. Les recherches de François Lamontagne (professeur-chercheur à la Faculté de médecine et des sciences de la santé et au CRCHUS) sur les corticostéroïdes, celles des chercheurs de l’IPS et celles d’autres experts à travers le monde démontrent hors de tout doute que la collaboration sera la clé de l’éventuelle solution à cette crise qui sévit depuis maintenant plusieurs mois.